- Forfatter Alex Aldridge [email protected].
- Public 2023-12-17 13:46.
- Sist endret 2025-06-01 07:37.
Nøkkelforskjellen mellom første- og andreordens reaksjoner er at hastigheten på førsteordens reaksjoner avhenger av første potens av reaktantkonsentrasjonen i hastighetsligningen, mens hastigheten på andreordens reaksjoner avhenger av andre potensen til konsentrasjonen ledd i renteligningen.
Reaksjonsrekkefølgen er summen av potensene som reaktantkonsentrasjonene heves til i ratelovens ligning. Det finnes flere former for reaksjoner i henhold til denne definisjonen; nullordensreaksjoner (disse reaksjonene avhenger ikke av konsentrasjonen av reaktanter), førsteordensreaksjoner og andreordensreaksjoner.
Hva er førstebestillingsreaksjoner?
Førsteordensreaksjoner er kjemiske reaksjoner hvor reaksjonshastigheten avhenger av den molare konsentrasjonen til en av reaktantene som er involvert i reaksjonen. Derfor, i henhold til definisjonen ovenfor for reaksjonsrekkefølgen, vil summen av potensene som reaktantkonsentrasjonene heves til i hastighetslovligningen alltid være 1. Det kan enten være en enkelt reaktant som deltar i disse reaksjonene. Deretter bestemmer konsentrasjonen av den reaktanten reaksjonshastigheten. Men noen ganger er det mer enn én reaktant som deltar i disse reaksjonene, da vil en av disse reaktantene bestemme reaksjonshastigheten.
La oss se på et eksempel for å forstå dette konseptet. I dekomponeringsreaksjonen til N2O5, danner den NO2 og O 2 gasser som produkter. Siden den bare har én reaktant, kan vi skrive reaksjonen og hastighetsligningen som følger.
2N2O5(g) → 4NO2(g) + O 2(g)
Rate=k[N2O5(g)]m
Her er k hastighetskonstanten for denne reaksjonen og m er rekkefølgen til reaksjonen. Derfor, fra eksperimentelle bestemmelser, er verdien av m 1. Dermed er dette en førsteordens reaksjon.
Hva er andre ordrereaksjoner?
Andre ordens reaksjoner er kjemiske reaksjoner hvor reaksjonshastigheten avhenger av den molare konsentrasjonen til to av reaktantene eller andre potensen til en reaktant som er involvert i reaksjonen. Derfor, i henhold til definisjonen ovenfor for reaksjonsrekkefølge, vil summen av potensene som reaktantkonsentrasjonene heves til i hastighetslovligningen alltid være 2. Hvis det er to reaktanter, vil reaksjonshastigheten avhenge av første potens av konsentrasjonen til hver reaktant.
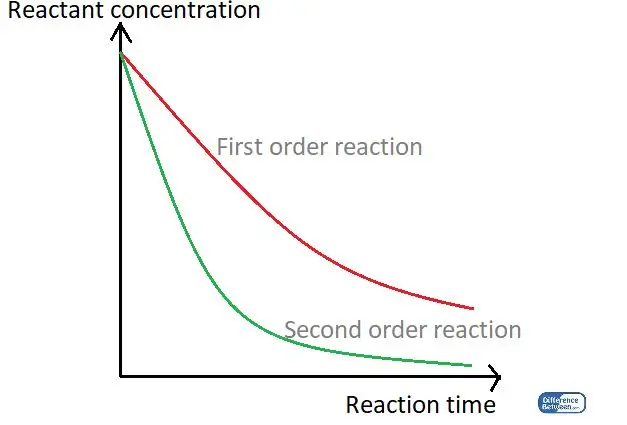
Figur 01: En graf som sammenligner de to typene reaksjonsrekkefølge ved å bruke deres reaksjonstid og reaktantkonsentrasjonen.
Hvis vi øker konsentrasjonen av en reaktant med 2 ganger (hvis det er to reaktanter i hastighetsligningen), så øker reaksjonshastigheten med 4 ganger. La oss for eksempel vurdere følgende reaksjon.
2A → P
Her er A en reaktant og P er produktet. Så hvis dette er en annenordens reaksjon, er hastighetsligningen for denne reaksjonen som følger.
Rate=k[A]2
Men for en reaksjon med to forskjellige reaktanter som følger;
A + B → P
Rate=k[A]1[B]1
Hva er forskjellen mellom første- og andreordensreaksjoner?
Førsteordensreaksjoner er kjemiske reaksjoner hvor reaksjonshastigheten avhenger av den molare konsentrasjonen til en av reaktantene som er involvert i reaksjonen. Derfor, hvis vi øker konsentrasjonen av reaktant med 2 ganger, øker reaksjonshastigheten med 2 ganger. Andreordens reaksjoner er kjemiske reaksjoner hvor reaksjonshastigheten avhenger av den molare konsentrasjonen til to av reaktantene eller andre potensen til en reaktant som er involvert i reaksjonen. Derfor, hvis vi øker konsentrasjonen av reaktant med 2 ganger, øker reaksjonshastigheten med 4 ganger. Infografikken nedenfor viser forskjellen mellom første- og andreordens reaksjoner i tabellform.

Sammendrag - første vs andre ordrereaksjoner
Det er tre hovedtyper av reaksjoner i henhold til rekkefølgen av reaksjonen; null orden, første orden og andre ordens reaksjoner. Den viktigste forskjellen mellom første- og andreordens reaksjoner er at hastigheten til en førsteordens reaksjon avhenger av den første potensen til reaktantkonsentrasjonen i hastighetsligningen, mens hastigheten til en andreordens reaksjon avhenger av den andre potensen til konsentrasjonsleddet i rate ligning.






