- Forfatter Alex Aldridge [email protected].
- Public 2023-12-17 13:46.
- Sist endret 2025-06-01 07:37.
Nøkkelforskjellen mellom nitrogenmonoksid og dinitrogenpentoksid er at nitrogenmonoksid er en fargeløs gass mens dinitrogenpentoksid er et hvitt fast stoff.
Nitrogenmonoksid og dinitrogenpentoksid er kjemiske forbindelser som inneholder nitrogen og oksygen. Dette er oksider av nitrogen. De har imidlertid forskjellige kjemiske og fysiske egenskaper.
Hva er nitrogenmonoksid?
Nitrogenmonoksid er en uorganisk forbindelse med den kjemiske formelen NO. Vi kaller det nitrogenoksid siden det er et nitrogenoksid. Det er faktisk en fri radikal fordi den har et uparet elektron. Dessuten er det et heteronukleært diatomisk molekyl.
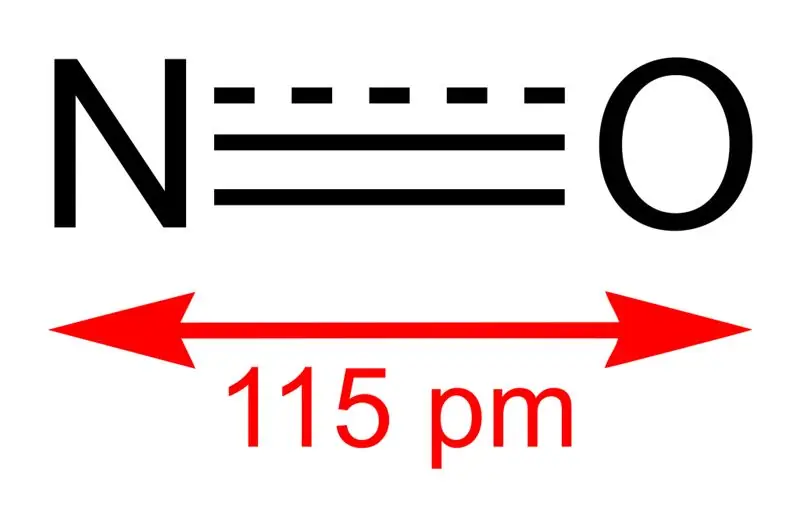
Figur 01: Struktur av nitrogenmonoksid og bindingslengden mellom N og O
Molmassen til denne forbindelsen er 30 g/mol. Det oppstår som en fargeløs gass. I tillegg er smeltepunktet -164 °C mens kokepunktet er -152 °C, som er svært små verdier sammenlignet med andre nitrogenoksider. Vi kan produsere dette frie radikalet via oksidasjon av ammoniakk ved 850 °C i nærvær av en platinakatalysator. På laboratorieskala kan vi imidlertid tilberede den ved å redusere fortynnet salpetersyre med kobber.
Hva er dinitrogenpentoksid?
Dinitrogenpentoksid er en uorganisk forbindelse med den kjemiske formelen N2O5 Vi kaller det nitrogenpentoksid. Det er et binært nitrogenoksid. Dessuten er den ustabil og kan fungere som et farlig oksidasjonsmiddel. Molarmassen til forbindelsen er 108,01 g/mol. Det forekommer en hvit farge solid.
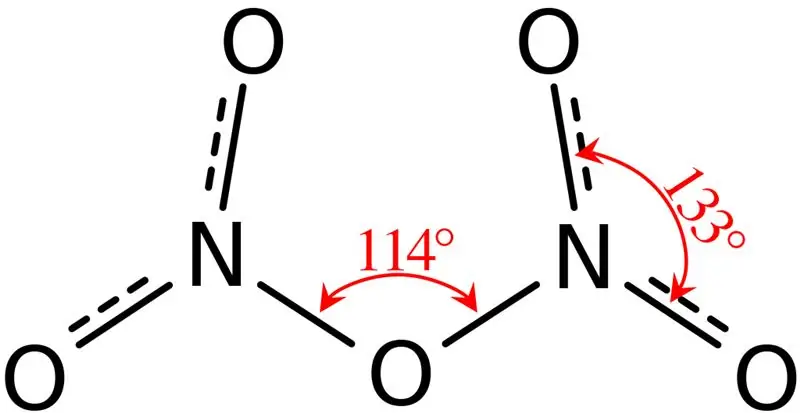
Figur 02: Strukturen til dinitrogenpentoksid
Videre er smeltepunktet til denne forbindelsen 41 °C, og ved 47 °C gjennomgår denne forbindelsen sublimering. Denne forbindelsen reagerer med vann og gir salpetersyre. I tillegg er den molekylære formen til dinitrogenpentoksid-molekylet plan. Vi kan produsere denne forbindelsen ved å dehydrere salpetersyre med fosforpentoksid.
Hva er forskjellen mellom nitrogenmonoksid og dinitrogenpentoksid?
Nitrogenmonoksid er en uorganisk forbindelse med den kjemiske formelen NO, mens dinitrogenpentoksid er en uorganisk forbindelse med den kjemiske formelen N2O5 Den viktigste forskjellen mellom nitrogenmonoksid og dinitrogenpentoksid er at nitrogenmonoksid er en fargeløs gass mens dinitrogenpentoksid er et hvitt fast stoff. Dessuten kan vi produsere nitrogenmonoksid via oksidasjon av ammoniakk ved 850 °C i nærvær av en platinakatalysator. Imidlertid skjer produksjonen av dinitrogenpentoksid via dehydrering av salpetersyre med fosforpentoksid. Når man vurderer den molekylære formen, er nitrogenmonoksid lineær mens dinitrogenpentoksid er plan.
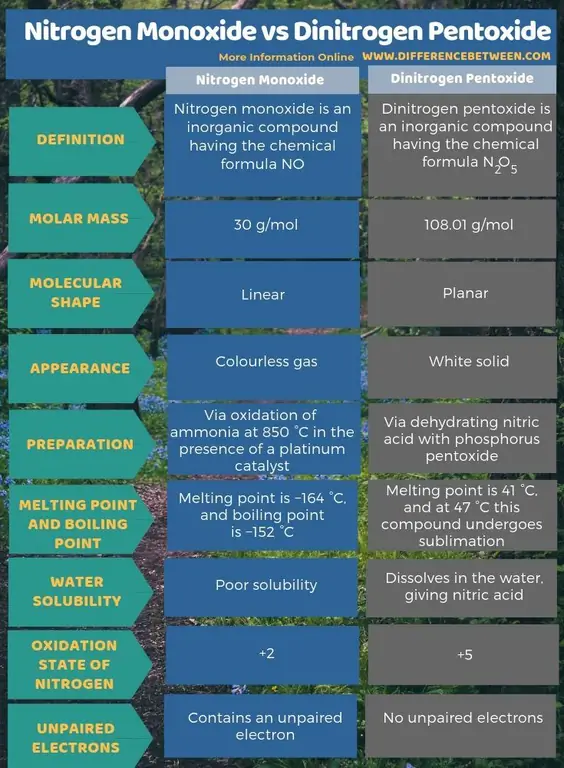
Sammendrag - Nitrogenmonoksid vs Dinitrogen Pentoxide
Nitrogenmonoksid er en uorganisk forbindelse med den kjemiske formelen NO, mens dinitrogenpentoksid er en uorganisk forbindelse med den kjemiske formelen N2O5 Hovedforskjellen mellom nitrogenmonoksid og dinitrogenpentoksid er at nitrogenmonoksid er en fargeløs gass mens dinitrogenpentoksid er et hvitt fast stoff.






