- Forfatter Alex Aldridge [email protected].
- Public 2023-12-17 13:46.
- Sist endret 2025-06-01 07:37.
Nøkkelforskjellen mellom karbonsyre og bikarbonat er at karbonsyre er en nøytral kjemisk forbindelse, mens bikarbonat er en negativt ladet kjemisk forbindelse.
Karbonsyre er en svak syre som dannes i løsning når karbondioksid løses opp i vann, med den kjemiske formelen H2CO3. Bikarbonat dannes ved kombinasjonen av tre oksygenatomer, et hydrogenatom og et karbonatom med den kjemiske formelen HCO3-.
Hva er karbonsyre?
Karbonsyre er H2CO3. Noen ganger gir vi dette navnet til løsninger som har karbondioksid oppløst i vann eller kullsyreholdig vann. Dette er fordi kullsyreholdig vann inneholder en liten mengde H2CO3. Videre er karbonsyre en svak syre, og den kan danne to typer s alter som karbonater og bikarbonater. Molmassen til denne forbindelsen er 62,024 g/mol.
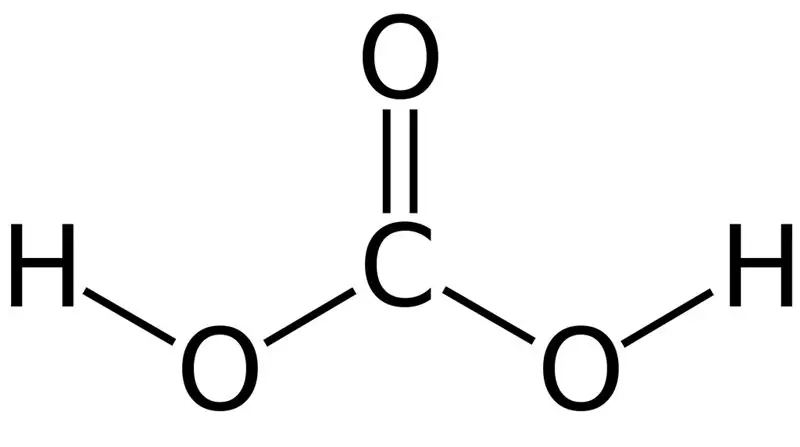
Figur 01: Den kjemiske strukturen til karbonsyre
Når karbondioksid løses opp i vann, går det inn i en likevekt mellom karbondioksid og karbonsyre. Likevekten er som følger:
CO2 + H2O ⟷ H2CO3
Hvis vi tilsetter et overskudd av karbonsyre til en base, gir det bikarbonat. Men hvis det er et overskudd av base, har karbonsyre en tendens til å gi kullsyres alter. Mer presist er karbonsyre en karboksylsyreforbindelse som har to hydroksylgruppesubstituenter festet til karbonylkarbonet. Dessuten er det en polyprotisk syre, som er i stand til å donere protoner. Den har to fjernbare protoner, så den er spesifikt diprotisk.
Hva er bikarbonat?
Bikarbonat dannes ved kombinasjonen av tre oksygenatomer, et hydrogenatom og et karbonatom. Produktet av denne kombinasjonen kan være et ion eller en forbindelse med flere elektroner enn protoner. Vi kan beskrive det som en kjemisk art med den kjemiske formelen HCO3-.
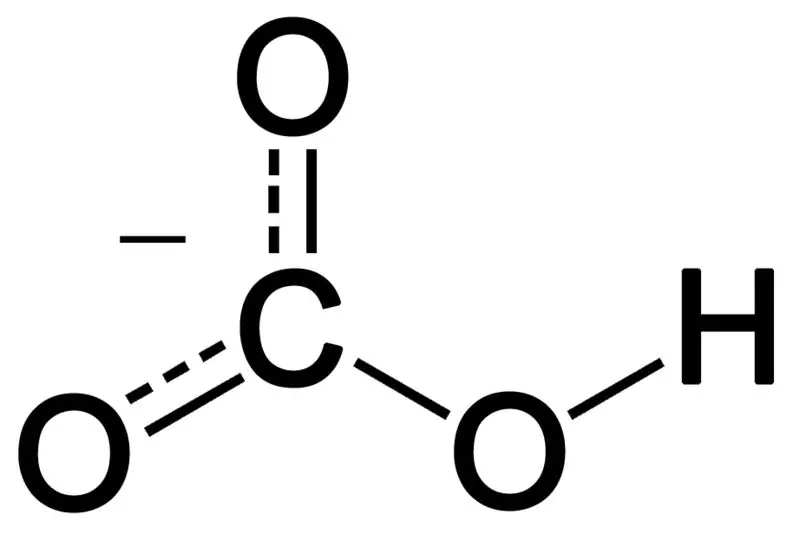
Figur 02: Den kjemiske strukturen til bikarbonatanion
Denne forbindelsen er en avgjørende del av kroppens pH-buffersystem, i lekmannstermer: den er ansvarlig for å holde ens blod i en tilstand som ikke er for sur eller for basisk. I tillegg fungerer det som en måte å holde fordøyelsessaftene i sjakk når magen er ferdig med å fordøye maten. Videre danner karbonsyre i regnvann bikarbonationer når det treffer steiner. Denne strømmen av bikarbonationer er viktig for å holde karbonsyklusen i gang.
Hva er forskjellen mellom karbonsyre og bikarbonat?
Karbonsyre er en svak syre som dannes i løsning når karbondioksid løses opp i vann, og dens kjemiske formel er H2CO3. Bikarbonat dannes ved kombinasjonen av tre oksygenatomer, et hydrogenatom og et karbonatom med den kjemiske formelen HCO3-. Den viktigste forskjellen mellom karbonsyre og bikarbonat er at karbonsyre er en nøytral kjemisk forbindelse, mens bikarbonat er en negativt ladet kjemisk forbindelse. Dessuten brukes karbonsyre til å lage boblende, brus, behandling av dermatitider, i munnvann, etc., mens bikarbonat brukes i matpreparater som baking (som hevemiddel), og det gir evnen til å motstå endringer i pH.
Følgende infografikk oppsummerer forskjellen mellom karbonsyre og bikarbonat i tabellform for side ved side sammenligning.
Opsummering - Carbonic Acid vs Bicarbonate
Karbonsyre er H2CO3. Bikarbonat dannes ved kombinasjonen av tre oksygenatomer, et hydrogenatom og et karbonatom, med den kjemiske formelen HCO3-. Hovedforskjellen mellom karbonsyre og bikarbonat er at karbonsyre er en nøytral kjemisk forbindelse, mens bikarbonat er en negativt ladet kjemisk forbindelse.






