- Forfatter Alex Aldridge [email protected].
- Public 2023-12-17 13:46.
- Sist endret 2025-06-01 07:37.
Nøkkelforskjell - sterk ligand vs svak ligand
En ligand er et atom, ion eller et molekyl som donerer eller deler to av elektronene sine gjennom en koordinert kovalent binding med et sentr alt atom eller ion. Begrepet ligander diskuteres under koordineringskjemi. Ligander er kjemiske arter som er involvert i dannelsen av komplekser med metallioner. Derfor er de også kjent som kompleksdannende midler. Ligander kan være Monodentate, Bidentate, Tridentate, etc. basert på dentisiteten til liganden. Dentisitet er antall donorgrupper som er tilstede i en ligand. Monodentate betyr at ligand har bare én donorgruppe. Bidentate betyr at den har to givergrupper per ligandmolekyl. Det er to hovedtyper av ligander kategorisert basert på krystallfeltteori; sterke ligander (eller sterke feltligander) og svake ligander (eller svake feltligander). Den viktigste forskjellen mellom sterke ligander og svake ligander er at splitting av orbitaler etter binding til en sterk feltligand forårsaker en høyere forskjell mellom orbitaler med høyere og lavere energinivå, mens splitting av orbitaler etter binding til en svakfeltligand forårsaker en lavere forskjell mellom orbitalene med høyere og lavere energinivå.
Hva er Crystal Field Theory?
Krystallfeltteori kan beskrives som en modell som er designet for å forklare brudd av degenerasjoner (elektronskall med lik energi) av elektronorbitaler (vanligvis d- eller f-orbitaler) på grunn av det statiske elektriske feltet som produseres av et omgivende område. anion eller anioner (eller ligander). Denne teorien brukes ofte for å demonstrere oppførselen til komplekser av overgangsmetallioner. Denne teorien kan forklare de magnetiske egenskapene, fargene til koordinasjonskomplekser, hydreringsentalpier, etc.
Teori:
Samspillet mellom metallionet og ligander er et resultat av tiltrekningen mellom metallionet med positiv ladning og den negative ladningen til de uparrede elektronene i liganden. Denne teorien er hovedsakelig basert på endringene som skjer i fem degenererte elektronorbitaler (et metallatom har fem d-orbitaler). Når en ligand kommer nær metallionet, er de uparrede elektronene nærmere noen d orbitaler enn andre d orbitaler av metallionet. Dette forårsaker tap av degenerasjon. Og også elektronene i d-orbitalene frastøter elektronene til liganden (fordi begge er negativt ladet). Derfor har d-orbitalene som er nærmere liganden høy energi enn andre d-orbitaler. Dette resulterer i splittelse av d orbitaler i høyenergi d orbitaler og lavenergi d orbitaler, basert på energien.
Noen faktorer som påvirker denne delingen er; metallionets natur, oksidasjonstilstanden til metallionet, arrangementet av ligander rundt det sentrale metallionet og liganders natur. Etter splittingen av disse d-orbitalene basert på energi, er forskjellen mellom høy- og lavenergi-d-orbitalene kjent som en krystallfelt-splittingsparameter (∆oct for oktaedriske komplekser).
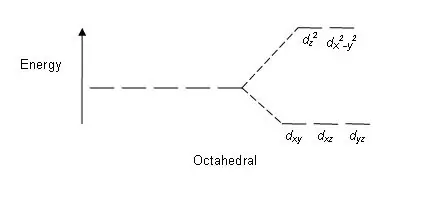
Figur 01: Splittingsmønster i oktaedriske komplekser
Splittemønster: Siden det er fem d-orbitaler, skjer sp altningen i forholdet 2:3. I oktaedriske komplekser er to orbitaler i det høye energinivået (samlet kjent som 'eg'), og tre orbitaler er i det lavere energinivået (samlet kjent som t2g). I tetraedriske komplekser skjer det motsatte; tre orbitaler er i det høyere energinivået og to i det lavere energinivået.
Hva er sterk ligand?
En sterk ligand eller en sterk feltligand er en ligand som kan resultere i en høyere krystallfeltsplitting. Dette betyr at bindingen av en sterk feltligand forårsaker en høyere forskjell mellom orbitalene med høyere og lavere energinivå. Eksempler inkluderer CN- (cyanidligander), NO2- (nitroligand) og CO (karbonyl) ligander).
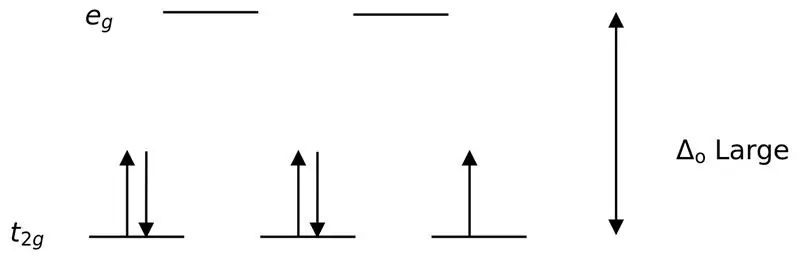
Figur 02: Splitting med lavt spinn
I dannelsen av komplekser med disse ligandene, blir til å begynne med de lavere energiorbitalene (t2g) fullstendig fylt med elektroner før de fylles til andre orbitaler med høyt energinivå (f.eks.). Kompleksene som dannes på denne måten kalles "lavspinnkomplekser".
Hva er svak ligand?
En svak ligand eller en svak feltligand er en ligand som kan resultere i en lavere krystallfeltsplitting. Dette betyr at bindingen av en svakfeltligand forårsaker en lavere forskjell mellom orbitalene med høyere og lavere energinivå.
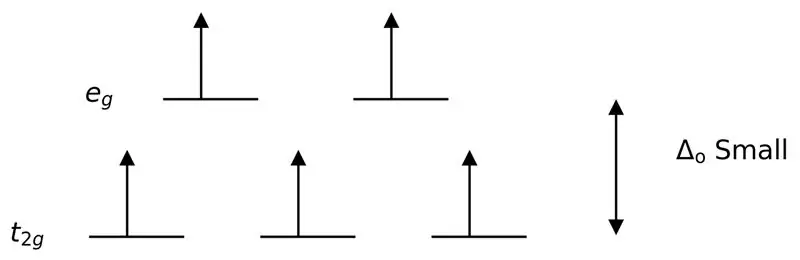
Figur 3: High Spin Splitting
I dette tilfellet, siden den lave forskjellen mellom de to orbitalnivåene forårsaker frastøting mellom elektroner i disse energinivåene, kan orbitalene med høyere energi lett fylles med elektroner sammenlignet med orbitaler med lav energi. Kompleksene dannet med disse ligandene kalles "høyspinnkomplekser". Eksempler på svakfeltligander inkluderer I- (jodidligand), Br- (bromidligand), etc.
Hva er forskjellen mellom sterk ligand og svak ligand?
Strong Ligand vs Weak Ligand |
|
| En sterk ligand eller en sterk feltligand er en ligand som kan resultere i en høyere krystallfeltsplitting. | En svak ligand eller en svakfeltligand er en ligand som kan resultere i en lavere krystallfeltsplitting. |
| Teori | |
| Splittingen etter binding av en sterk feltligand forårsaker en høyere forskjell mellom orbitalene med høyere og lavere energinivå. | Splittingen av orbitaler etter binding av en svakfeltligand forårsaker en lavere forskjell mellom orbitalene med høyere og lavere energinivå. |
| Kategori | |
| Kompleksene dannet med sterke feltligander kalles "lavspinnkomplekser". | Kompleksene dannet med svake feltligander kalles "høyspinnkomplekser". |
Sammendrag - sterk ligand vs svak ligand
Sterke ligander og svake ligander er anioner eller molekyler som forårsaker sp altning av d orbitaler av et metallion i to energinivåer. Forskjellen mellom sterke ligander og svake ligander er at sp altningen etter binding av en sterk feltligand forårsaker en høyere forskjell mellom orbitalene med høyere og lavere energinivå, mens sp altningen av orbitaler etter binding av en svakfeltligand forårsaker en lavere forskjell mellom høyere og lavere. energinivå orbitaler.






